ALDEHÍDOS
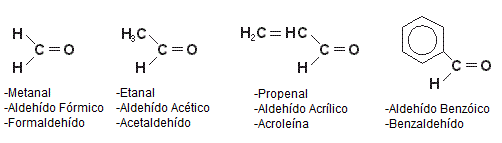
NOMENCLATURA Y EJEMPLOS:PROPIEDADES FÍSICAS:
A temperatura de 25ºC, los aldehídos con uno o dos carbonos son gaseosos, de 3 a 11 carbonos son líquidos y los demás son sólidos. Los aldehídos más simples son bastante solubles en agua y en algunos solventes apolares.
Presentan también olores penetrantes y generalmente desagradables. Con el aumento de la masa molecular esos olores van volviéndose menos fuertes hasta volverse agradables en los términos que contienen de 8 a 14 carbonos. Algunos de ellos encuentran inclusive su uso en perfumería (especialmente los aromáticos).
El grupo carboxilo confiere una considerable polaridad a los aldehídos y por esto poseen puntos de ebullición más altos que otros compuestos de peso molecular comparable.
Mientras tanto, no se forman enlaces de hidrógeno intermoleculares, visto que ellos contienen apenas hidrógeno enlazado al carbono. Comparándose las cetonas con los aldehídos isómeros, las cetonas tienen punto de ebullición más elevado y son más solubles en agua, pues sus moléculas son más polares que las de los aldehídos.
PROPIEDADES QUÍMICAS:
Los aldehídos tienen buena reactividad. Presentan reacciones de adición, sustitución y condensación.
De adición:
Adición de Hidrógeno:
Adición de Oxígeno:
Reducción del Nitrato de plata (AgNO3) amoniacal ( Reactivo de Tollens).
La plata en medio amoniacal es reducida por el aldehído. Esto se verifica por la aparición de un precipitado de plata llamado espejo de plata en el fondo del tubo d ensayo.
En primer lugar se forma hidróxido de plata.
AgNO3 + NH4OH → NH4NO3 + AgOH
Posteriormente la plata es reducida hasta formar el espejo de plata.
Reducción del Licor de Fehling:
El licor de Fehling está conformado de dos partes.
I) Una solución de CuSO4
II) NaOH y Tartrato doble de Na y K.
Al reunir ambas soluciones se forma hidróxido cúprico:
CuSO4 + 2 NaOH → Na2SO4 + Cu(OH)2
Este hidróxido con el tartrato, forma un complejo de color azul intenso. Cuando a esta mezcla se le agrega un aldehído, y se la somete al calor, el cobre de valencia II se reducirá a cobre de valencia I. el aldehído se oxidará como en el caso anterior formando un ácido orgánico. La reducción del cobre se evidencia por la aparición de un precipitado rojo de óxido cuproso.
Sustitución con halógenos:
Los aldehídos reaccionan con el cloro dando cloruros de ácidos por sustitución del hidrógeno del grupo carbonilo.
Aldolización:
Esta dentro de las reacciones de condensación.
Se da cuando dos moléculas de aldehído se unen bajo ciertas condiciones como la presencia de hidróxidos o carbonatos alcalinos.
Al unirse se forma una molécula que tiene una función alcohol y otra función aldehído en la misma molécula.
A este compuesto también se lo llama aldol por la combinación entre un alcohol y un aldehído.
Reacción indicadora de la presencia de aldehídos:
El reactivo llamado de Schiff es una solución de fucsina (colorante rojo violáceo). Este reactivo se puede decolorar con ciertos reactivos como el SO2 hasta volverlo incoloro. Pero cuando se le agrega una solución que contenga aldehído, el reactivo vuelve a tomar su color rojo violáceo.
Los aldehídos tienen la capacidad de adicionar a su molécula al SO2y de esta manera dejar libre a la fucsina del reactivo que le provoco su decoloración.
USOS DE LOS ALDEHÍDOS:
1- Fabricación de plásticos.
2- Fabricación de resinas.
3- Fabricación de productos acrílicos.
5- Industria explosiva.
6- Industria colorante.
7- Como antiséptico y preservador.
11- Acelerador en la vulcanización.
12- Irritativos respiratorios, dérmicos y oculares (a temperatura ambiente, presenta un riesgo limitado de toxicidad).




17- Producción de piensos.
BENEFICIOS Y RIESGOS PARA LA SALUD:
La mayor parte de los aldehídos pueden causar irritación de la piel, los ojos y el sistema respiratorio, siendo este efecto más pronunciado en los miembros inferiores de una serie, en los miembros con la cadena alifática insaturada y en los miembros con sustitución halógena. Los aldehídos pueden tener un efecto anestésico, pero las propiedades irritantes de algunos de ellos posiblemente obligen al trabajador a limitar la exposición antes de que ésta sea suficiente como para que se manifiesten los efectos anestésicos. El efecto irritante en las mucosas puede estar relacionado con el efecto cilioestático que inhibe el movimiento de los cilios que tapizan el tracto respiratorio con funciones esencialmente de limpieza. El grado de toxicidad varía mucho en esta familia. Algunos aldehídos aromáticos y ciertos aldehídos alifáticos se metabolizan rápidamente y no producen efectos adversos, pudiendo utilizarse sin riesgos como aromas alimentarios. No obstante, otros miembros de la familia son cancerígenos conocidos o sospechosos y exigen la adopción de medidas de precaución siempre que exista posibilidad de contacto con ellos. Algunos son mutágenos químicos y otros, alergenos. También tienen la capacidad de producir un efecto hipnótico.
Propiedades de los aldehídos
Propiedades químicas de los aldehídos
Usos de los aldehídos
Beneficios y riesgos para la salud aldehídos
Google imágenes













No hay comentarios.:
Publicar un comentario